
基因療法作為一種治療由缺陷基因引起的多種疾病的方法,具有巨大的潛力。然
而,迄今為止,基因遞送到身體正確部位的一個主要障礙是難以避免產生基因脫
靶效應(無效遞送)。另外,注射的基因遞送通常會在肝臟中積聚,因此目前大
部分基因治療藥物(如mRNA、DNA)皆針對肝臟疾病作為應用。其中,直接注
射到肌肉組織中的基於RNA的COVID-19疫苗也被證明是有效的。在許多情況
下,基因藥物被包裹在脂質納米顆粒中(微脂體),而此類非病毒型藥物載體,
其基因表達效率通常較低,因此,如何更有效表達基因在特定目標的器官,並有
效提升非病毒型基因轉染效應,依舊是需要突破的目標。
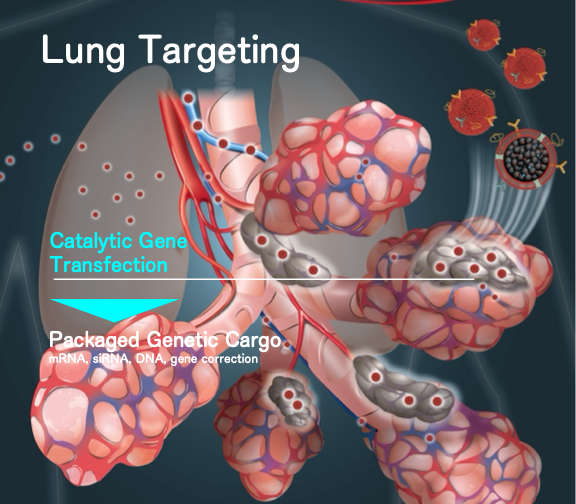
目前主流的核酸藥物載體,無論是病毒載體還是脂質奈米顆粒,主要在肝臟累
積,缺乏在肺部進行遞送的能力。因此,肺部基因治療藥物的開發面臨著最大的
困難:(1) 無法在肺部患病部位有效累積,導致療效不佳或需要提高劑量;(2) 在
其他器官組織造成不必要的曝露和脫靶毒性。為了徹底改善肺部基因治療的有效
性和安全性,我們的團隊通過結合不同材料特性開發了一種新型肺部傳遞核酸載
體,能夠在靜脈注射時有效地將核酸基因治療藥物運送到肺部並累積在那裡,並
利用世界首創催化轉染效應(Catalytic transfection)高度提升效率,在基因遞送
領域首次提出利用肺臟主動標靶與催化達到局部標靶轉染目標。
我們選擇肺癌作為初步的疾病治療模型,並使用新型載體結合siRNA藥物。透過
初步的細胞和動物概念驗證研究,我們確定這種組合能夠抑制癌細胞中的PD-L1
蛋白表達。這項研究已經確認該新型載體在肺部有高效的累積能力,並具有核酸
轉染的能力。在肺轉移腫瘤動物模型中,我們觀察到腫瘤內免疫活性的提升,並
初步展示了治療效果。同時,我們的團隊也在進行不同類型核酸藥物的測試,包
括Plasmid DNA和Messenger RNA等,在細胞實驗中均顯示出高度的轉染活
性,這顯示了這種新型核酸載體具有廣泛的應用空間和價值。目前,我們也將應
用在眼睛的基因治療(RS1)上,期望本催化強化轉染效應能夠克服過去難以基因治
療的目標。
國立清華大學(National Tsing Hua University, NTHU)成立於1911年,位於新竹市,是台灣頂尖的研究型大學之一。學校提供多元的學科領域,包括工程、科學、管理、人文等,致力於創新研究與國際化發展。
技術成熟度:實驗室階段
展示目的:研發成果展示
流通方式:自行洽談
*服務單位
*姓名
*電話
*您參觀這項展品的主要目的?
*您是否希望進一步洽談
*您的職務類別
*展覽整體評價
*最喜歡的展區
*期待展覽著重的技術領域
*是否願意收到電子報/最新資訊
其他建議
敬請期待!